https://ncats.nih.gov/about/about-translational-science/resources
바이오제약 오픈 채팅 (링크)
연구단계하고 비임상 단계를 거치면서, 회사 내부에서는 이 물질, 파이프라인에 대해서 실제로 일을 진행 할지를 몇개월 단위로 평가를 계속한다.
회사내부에서의 평가는 파이프라인 스스로의 경쟁력, 타사에서 준비중인지, 약이 출시가 되어도 환자가 많은지, 환자는 많은데 실제로 매출이 많이 나올지, 개발 가능한 기술을 현재 회사가 가지고 있는지, 생산 가능한지, 여러가지 방면으로 평가한다.
내가 경험한 가장 황당한 폐지 사유는 내가 봤을 때는 좋아보이는 컨셉이었는데, 회사 내부의 다른 파이프라인하고 경쟁할 가능성이 있어서 둘 중에 하나만 개발하기로 하고, 나머지 하나는 폐지했다. ㅋㅋ
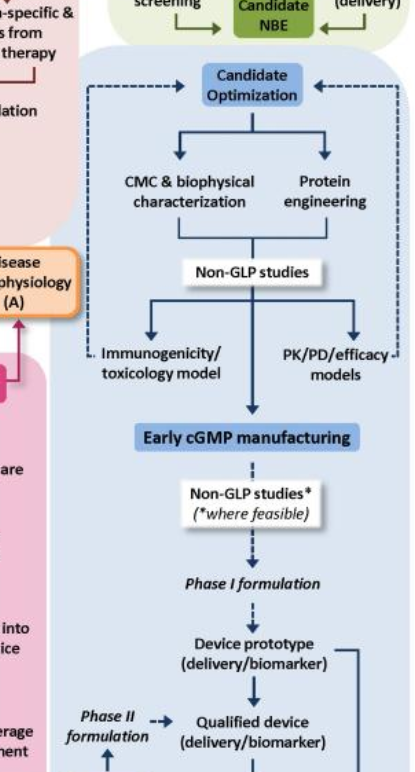
candidate optimization을 하는 부서가 따로 있는 것은 아닌것 같고, 후보물질에 대해서 특성 분석 (characterization analysis), 공식적인 GLP를 진행하기 전에 비공식적으로 비임상 실험을 준비한다. 비임상에서는 보통 마우스, 랫, 기니피그, 원숭이 등을 사용하여 동물 체내에서 약을 투여했을 경우 약의 pharmacokinetics, pharmacodynamics, toxicological effects, pharmacology study 등을 수행하고, 바이오의약품의 경우에는 바이오의약품 자체가 항원으로 인식되어 체내에서 면역 반응을 일으킬 수 있으므로 immunogenecity study도 수행한다.
이러한 비임상 과정을 수행하면서 그 다음 단계인 CMC도 동시에 진행을 하게 된다.
CMC 단계는 보통 생산을 위한 전반적인 단계라고 생각할 수 있는데, 간단하게 말하면 삼성 바이오로직스 같은 CMO가 수행하는 전반적인 과정을 회사내부에서 개발을 진행하게 된다.
CMO에게 일을 의뢰하기 전에, 회사 내부에서 1차적인 개발을 통해서 process development, purification, filling, formulation development, analytical development, master cell banking, working cell banking 등의 과정들을 수행한다.
upstream은 이 과정에서 주로 process development를 말하는 것 같고, 보통 한국어로는 배양이라고 부른다. 배양개발 과정은 바이오리액터에 각종 첨가물과 배지, 그리고 1차적으로 개발이 완료된 working cell bank를 투입하여 1주일에서 2주일 정도 배양을 하게 된다.
보통 실험실 단위에서는 배양접시에서 세포를 배양하여, 배양접시에 붙은 상태로 세포를 배양하게 되지만, 바이오의약품에서의 배양은 그러한 형태로는 원하는 수준의 생산 스케일을 만들수가 없어서 바이오리액터 형태로 수만 리터, 그보다 더 크다면 수십만 리터 스케일로 키우게 된다.
이러한 개발 과정을 회사에서 수행하고, qualification, validation까지 끝나게 된다면 이제 회사 내부에서 직접 생산을 하든지, 아니면 보통 CMO에 tech transfer를 진행해서, CMO에서도 똑같은 방식으로 똑같은 제품이 생산될 수 있도록 process validation를 진행한다.
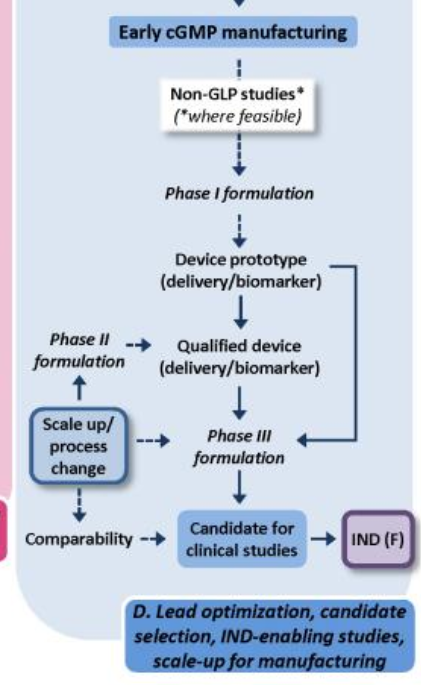
CMC에서는 임상 1, 2, 3상이 진행 될 수록 생산 스케일이나, 밸리데이션을 완료해 나가는데, 회사 수뇌부에서 갑자기 프로젝트 폐지가 나오게 된다면 그동안 개발해왔던 활동은 사장되게 된다.
CMO로 기술이전을 하여 생산되는 물질들은 회사 내부에서 만들어진 표준물질과 비교하여 품질적으로 변화, 차이가 있는지 매우 엄격하게 확인한다.
보통 말하는 QC (quality control)직무는 analytical development와는 엄격하게 말하면 다른 직무이고, analytical development가 analytical method의 개발, 관리 등에 중점을 둔다면 QC직무는 개발된 시험법의 실질적인 운용에 중점을 두는 직무이다. 따라서 QC직무는 같이 근무하는 경우가 회사에 따라 다를 수 있고, CMO에서는 QC직무가 더 많을 것이다. CMO에서는 생산된 바이오의약품의 품질검사를 해야하기 때문이다. 품질검사를 담당하는 직무가 QC직무다.
이러한 업무를 담당하는 부서는 analytical development로 method development, reference standard, working standard management, method qualficaation 등을 통해서 임상시험, CMC development 전체를 통틀어서 생산되는 물질들의 품질이 변하지 않도록 관리한다.
CMC직무에 필요한 역량
이 과정을 포함하여, upstream, downstream, analytical development 등 CMC 관련 직무들의 작업은 항상 기록이 되어있어야 하고, 나중에 승인 받을 경우 모든 과정은 다시 한번 허가당국에서 직접 조사를 통해서 사후적으로 지적을 받을 수도 있고, 사안의 위반 경중에 따라 신약허가는 실패할 수도 있다. 자의적인 해석, 마음대로 변경, 삭제, 추가하지 못하도록 엄격하게 전 과정이 기록된다.
기존 자료, 데이터, 기록서의 변경, 삭제, 추가를 해야하는 상황이라면 모든 과정은 합리적이고, 과학적인 근거에 의해서 수행되어야 하고, 그렇지 못할 경우 나중에 오히려 지적을 받았을 때 허가당국의 신뢰를 받지 못해 신약 승인에 지장이 생길 수 있다.
따라서 CMC, GMP 수준을 유지하는 과정에서 일하는 것은 매우 피곤하다.
글씨체까지 관리하고, 실험실 입출입, 기기사용, 냉장고 오픈 등등 사소한 작업 모두 기록이 되도록하고 수행은 인간이 하지만, 실제로 인간이 재량으로 할 수 있는 영역은 가장 적은 과정이다.
그렇기 때문에 CMC만 그런 것은 아니지만, 실제로 작업을 수행하는 사람의 신뢰성, 그리고 기록을 정직하게 기록하고, 발생한 돌발적인 사고, 사건에 대해서 분석, 논리적 사고를 하여 기록을 하고, 추후에 필요하다면 과학적 근거에 의해서 조사를 진행할 능력이 필요한 과정이다.
Development, Qualification: 제약회사
Validation, Manufacturing: CMO
이런 역할을 나누어서 진행하는 경우가 많고, 제약회사가 귀찮거나, 돈이 많으면 개발까지 CMO에게 맡기는 경우가 있는데, CDMO라고 한다.
일본 또는 미국 현지 제약회사 (or 바이오테크)에 유학, 취업, 이민 (NIW) 가시려는 분들이 있다면 꼭 와주세요. 이미 일본, 미국, 그 외 해외 국가에 있는 분들이 많이 있습니다.
제 경력은 이렇습니다.
前) 일본 국립대 박사과정 (면역학) 졸업, 일본 국립 연구소 연구 경험
前) 한국 제약회사 대기업 박사급 연구원
現) 일본 제약회사 대기업 drug discovery division 박사 연구원 재직 중